Diabetes. S. m. e f. Patol. 1. Síndrome caracterizada por uma eliminação exagerada e permanente de urina. 2. Restr.V. diabetes melito. [Var.: diabete, diabetes mellitus]. |
1. Introdução
O diabetes melito (DM) é uma síndrome sistêmica, crônica e evolutiva caracterizada pela alteração do metabolismo de carboidratos, gorduras e proteínas, decorrente da falta de insulina ou da sua incapacidade de agir adequadamente. O excesso de glicose no sangue, caracterizado por hiperglicemia está presente, e dentre as complicações que surgem no curso evolutivo da doença, encontram-se alterações macrovasculares, microvasculares e neurológicas.
O termo "diabetes" foi primeiro usado no segundo século D.C., e significa excessiva emissão de urina, achado freqüente na doença. A palavra "mellitus" provém do latim, traduzindo-se em "adoçado com açúcar", em referência à presença de glicose na urina dos pacientes.
2. Epidemiologia
O DM é uma das doenças crônicas mais comuns, trazendo problemas tanto de saúde, quanto problemas econômicos. Segundo estimativas da Organização Mundial de Saúde, em 1997 existiam 142,5 milhões de casos de DM no planeta (36,8 % em países desenvolvidos e 63,2% nos países em desenvolvimento), projetando 154,4 milhões de casos para o ano 2000 e para 2025, 299,9 milhões de pessoas afetadas (76% em países em desenvolvimento). Há uma tendência da prevalência aumentar devido ao alargamento da longevidade e às mudanças de hábitos atribuídas à crescente urbanização.
No Brasil, estima-se haver mais de 5 milhões de diabéticos, projetando-se mais de 11 milhões para 2025. A prevalência do DM na população de 30 a 69 anos é estimada, a partir de dados em 9 capitais (ver tabela abaixo), em 7,6%, porcentagem semelhante a de países desenvolvidos. A doença concentra-se na faixa de 60 a 69 anos (17,43% da população na faixa etária possui DM) e afeta homens e mulheres igualmente. Trata-se da quarta causa de morte no Brasil, com alta taxa de morbidade, além de mortalidade.
Os custos econômicos diretos e indiretos decorrentes dos gastos com a doença representam de 5 a 14% dos gastos em saúde no Brasil. Nos Estados Unidos, os gastos com o diabetes ficam em torno de US$ 138 bilhões/ano.
Faixa Etária
Porcentagem (%)
30 - 39 anos
2,7
40 - 49 anos
5,52
50 - 59 anos
12,66
60 - 69 anos
17,43
Prevalência de DM segundo as faixas etárias.
Cidade
Porcentagem (%)
Brasília 5,22
Recife 6,42
Fortaleza 6,48
Belém 7,16
Rio de Janeiro 7,47
Salvador 7,87
João Pessoa 7,95
Porto Alegre 8,89
São Paulo 9,66
Total no Brasil 7,60
Prevalência de DM em capitais brasileiras e o total no Brasil
3. Classificação
O DM é classificado, de acordo com a American Diabetes Association (ADA)/National Institute of Health (NIH) da seguinte maneira:
- DM insulinodependente ou tipo 1 (DMID)
- DM não-insulinodependente ou tipo 2 (DMNID)
- Não obeso
- Obeso
- DM relacionado à desnutrição
- Outros tipos de DM associado com certas condições e síndromes (doença pancreática, doença de etiologia hormonal, condições induzidas por drogas ou produtos químicos, anormalidades de insulina ou dos seus receptores, certas síndromes genéticas, miscelânea)
- Tolerância à glicose diminuída
- Diabetes melito gestacional
- Anormalidade prévia de tolerância à glicose
- Anormalidade potencial da tolerância à glicose
3.1 DM Insulinodependente
O DM insulinodependente (DMID) caracteriza-se pela ausência de produção da insulina, devido à destruição das células beta pancreáticas. Essa destruição é um processo que ocorre em fases, sendo necessário haver susceptibilidade genética ou uma possível ação viral nas células beta. Os pacientes com DMID são geralmente magros (devido à falta da ação anabólica da insulina) e jovens. Verificam-se picos na metade da 1ª década (talvez por maior exposição a vírus) e na adolescência (talvez pelo aumento da síntese de GH, fazendo antagonismo com a insulina). Esta forma de DM compreende cerca de 5%.
Como não há produção de insulina, existe a necessidade absoluta de administração de insulina exógena nesses pacientes, caso contrário pode ocorrer uma complicação conhecida como cetoacidose, a qual se instala abruptamente, podendo ser o primeiro sintoma da doença.
A agregação familiar é incomum, verificando-se que um irmão gêmeo monozigótico tem menos de 50% de chances de ter DMID.
O DMID pode ser denominado como sendo uma doença auto-imune geneticamente programada. Ao estudar o ciclo evolutivo da doença, verifica-se que existem 5 fases até a instalação dos sintomas.
- Estágio I
: refere-se à susceptibilidade genética do indivíduo, relacionada ao complexo HLA. Sabe-se que HLA-DR3 e HLA-DR4 relacionam-se positivamente com o desenvolvimento da doença, ao passo que HLA-DR2 relaciona-se negativamente.- Estágio II:
refere-se a uma evento precipitante de destruição ou de desenvolvimento de auto-imunidade contra as células beta. Acredita-se que vírus possam desencadear esse processo através da (1) destruição celular direta, (2) geração de citocinas que destroem as células, ou (3) indução de auto-imunidade cruzada. Esse papel é atribuído a vírus principalmente pela observação de que a incidência de DMID é maior no outono/inverno e coincide com infecções tais como caxumba, rubéola, influenza e CMV.
- No estágio III surgem evidências da existência de anormalidades imunológicas ativas, tais como (1) a observação da associação do DMID a antígenos de classe II, os quais estão ligados a doenças auto-imunes, (2) à ocorrência de DMID concomitante a outras endocrinopatias imunes, anemia perniciosa, miastenia gravis e vitiligo, (3) à presença de infiltrado linfocítico nas ilhotas, semelhante a outras doenças auto-imunes, (5) à presença de anticorpos direcionados contra a superfície e o citoplasma das ilhotas, (6) o fato de que o DMID pode ser revertido em ratos através de imunoterapia e (7) a rápida destruição das células beta em pâncreas transplantado de um gêmeo monozigótico sem DMID para o gêmeo com DMID, sem haver rejeição. Esses 7 itens reforçam o fato de que o DMID é uma doença auto-imune. A destruição das células é inicialmente mediada por linfócitos T não-dependentes e depois, por linfócitos T helper do tipo 1, os quais suprimem LT helper tipo 2 e estimulam macrófagos a destruírem as células beta.
- No estágio IV há perda progressiva da secreção de insulina
- No estágio V, surge o DM com manifestação de seus sintomas.
3.2 DM Não-Insulinodependente
Os pacientes com DMNID não dependem da insulina exógena. Nessa doença, existe uma diminuição da secreção da insulina, mas não sua abolição, ou um aumento na resistência dos receptores à ação da insulina - ou ainda a associação dos dois. Os pacientes são tratados com dieta, exercícios e antidiabéticos orais, no entanto, pode ser necessária a introdução de insulina no decorrer dos anos para melhor controle metabólico. Como existe algum nível de insulina, não há tendência de desenvolvimento de cetoacidose. O DMNID é diagnosticado mais freqüentemente em pacientes com mais de 40 anos. Cerca de 80% dos afetado são obesos. A maioria passa longos períodos sem sintomas e a primeira indicação clínica da doença pode ser a complicação crônica. Esta forma de diabetes é a mais comum, correspondendo a 90% dos casos.
Ao contrário do DMID, o DMNID possui um padrão de transmissão genético autossômico dominante, podendo haver agregados familiares.
A resistência à ação da insulina pode ser atribuída a mutações no substrato protéico necessário para a síntese da enzima tirosina quinase do receptor (IRS-1), no próprio receptor para insulina, ou nas diversas proteínas envolvidas no transporte e metabolismo de glucose (ex. GLUT 2, GLUT 4, Hexoquinase II, glicogênio sintase). Além disso, a obesidade pode levar à resistência através da down regulation de receptores para insulina principalmente.
De fato, obesidade e DMNID se relacionam fortemente. Por um lado, geralmente a obesidade induz à resistência a insulina e, conseqüentemente, ao DMNID. Por outro, o hiperinsulinismo existente no DMNID decorrente da resistência dos receptores, leva à alteração do metabolismo, dirigindo-o para o anabolismo, ou seja, acúmulo de energia e de gordura, causando obesidade.
No estágio inicial do DMNID, a resistência à insulina leva a um hiperinsulinismo compensatório. Esse excesso de insulina leva à lipogênese, sendo altamente aterogênico, podendo causar obstruções arteriais e trombose, além de dislipidemia e hipertensão arterial. No estágio final, a capacidade das células beta em produzir insulina cai drasticamente, agravando a doença.
Características
DMID
DMNID
Idade
Jovem
Acima de 40 anos
Tipo físico
Magro
Obeso
Insulina plasmática
Baixa ou ausente
Normal ou elevada
Complicação aguda
Cetoacidose
Coma hiperosmolar
Insulinoterapia
Responsivo
Responsivo ou resistente
Hereditariedade
Não
Autossômica dominante
Prevalência
5 a 10 %
90 a 95 %
3.3 DM Relacionado a Desnutrição
Presente em jovens com histórico de desnutrição calórico-protéica, a qual leva a fibrose e calcificações do pâncreas.
3.4 Tolerância Diminuída a Glicose
Corresponde a glicemia intermediária entre o normal e o DM instalado. Pode evoluir a DM, regredir até o normal ou permanecer inalterado. Cerca de 50% dos casos evoluem a DM, sendo que esse risco pode ser diminuído com exercícios e dieta. É um fator de risco para o desenvolvimento de DM e de doença cardiovascular.
3.5 DM Gestacional
Consiste em DM ou tolerância à glicose diminuída diagnosticado pela primeira vez durante a gestação. Trata-se de uma das principais causas de óbito fetal. O DM durante a gestação predispõe a diversas alterações, tais como bacteriúria assintomática, pielonefrite, toxemia gravídica, vulvovaginites, infecção puerperal, aborto, prematuridade, polidrâmnio, má-formações, macrossomia fetal e síndrome da membrana hialina.
3.6 Anormalidade prévia de tolerância à glicose
Compreende indivíduos com tolerância à glicose normal, mas com história de DM ou de intolerância à glicose transitória. Enquadrados nessa condição citam-se grávidas com DM gestacional que voltaram ao normal após o parto, estresse metabólico, pós-trauma
3.7 Anormalidade potencial da tolerância à glicose
Anormalidade potencial da tolerância à glicose engloba pessoas com fatores de risco para o desenvolvimento de DM (idade avançada superior a 40 anos, história familiar de DM, obesidade, antecedentes de recém-nascido macrossômicos, de óbito fetal ou de complicações neonatais próprias do DM, presença de doença vascular aterosclerótica anterior aos 50 anos, dislipidemia e hipertensão).
4. Diagnóstico
O diagnóstico de DM é feito seguindo um dos três critérios:
- Presença de sintomas clássicos e glicemia plasmática venosa de jejum maior ou igual a 126 mg/dl ou 200 mg/dl, medida a qualquer hora do dia;
- Assintomático com glicemia plasmática venosa de jejum 126 mg/dl confirmada em duas ou mais ocasiões;
- Glicemia plasmática venosa na amostra de 2 horas no teste oral de tolerância à glucose com 75g (TOTG) 200 mg/dl.
Uma pessoa normal pode apresentar uma taxa glicêmica em jejum entre 110 e 126 mg/dl ou entre 140 e 200 mg/dl no TOTG.
Glicemia de jejum
TOTG 2horas
Normal
110 mg/dl
140 mg/dl
Intolerância à glicose
110-126 mg/dl
140-200 mg/dl
DM
126 mg/dl
200 mg/dl
O teste oral de tolerância à glicose corresponde à ingestão de 75 gramas de glucose anidra dissolvidos em 300 ml de água, em período não superior a 5 minutos. O jejum deve ser de 10 a 14 horas, com consumo mínimo de 150 g de carboidratos por dia nos 3 dias anteriores ao teste. Durante o teste, o paciente deve ficar em repouso e não deve estar acamado, doente ou com infecções. O uso de medicamentos que alterem a glicemia deve ser suspenso 12 horas antes do teste. É vetado o fumo ou café na manhã do teste
O rastreamento de DM gestacional deve ser feito a partir da 20ª semana de gestação, por meio do teste oral de tolerância à glicose simplificado, com 50 g de glicose. A glicemia é dosada 1 hora após a ingesta, sendo o ponto de corte igual a 130 mg/dl. O rastreamento também pode ser feito com uma glicemia de jejum, com ponto de corte 85 mg/dl. Esses achados não são diagnósticos, mas sim uma triagem, sendo necessário investigação diagnóstica.
5. Manifestações Clínicas
As manifestações próprias do DM compreendem os "pês" clássicos
- Poliúria: aumento do volume urinário devido à diurese osmótica causada pela glicose;
- Polifagia: fome para contrabalançar o estado de catabolismo promovido pela falta de insulina;
- Polidipsia: sede excessiva, para contrabalançar a perda de água.
Também podem ocorrer irritabilidade, infecções freqüentes (pela imunossupressão relativa causada pelo hipercatabolismo), fadiga, perda de sensibilidade de extremidades (pela neuropatia), visão embaçada (pela retinopatia ou alteração do cristalino), perda de peso e alterações de coagulação (pelo catabolismo).
A primeira manifestação do DMID pode ser a cetoacidose diabética, atribuída à hipoinsulinemia e à elevação de hormônios antagônicos (GH, catecolaminas, glucagon e cortisol). Essa complicação não se relaciona com hiperglicemia (embora ela freqüentemente esteja presente), mas sim à hipoinsulinemia, causada pelo seu uso inadequado, estresse, doenças intercorrentes ou infecções. A cetoacidose decorre da falta de insulina, presença de hormônios antagônicos, que leva à lipólise, com liberação de ácido graxos livres, os quais são degradados a ácido acetoacético e beta-hidroxibutírico, ou a combinação dos dois fatores. A presença desses ácidos no sangue desencadeia manifestações tais como hiperpnéia (respiração de Kussmaul), cetonúria, hálito cetônico, cetoacidose (pH arterial menor que 7,2 com concentração de corpos cetônicos maior que 300 mg/dl), espoliação de potássio (pelo antiporte H+/K+), desidratação grave (pela diurese osmótica causada pela glicosúria, podendo evoluir a insuficiência renal) e hiperglicemia (geralmente maior que 300 mg/dl). Podem estar associados náuseas, vômitos, anorexia, dor abdominal (pseudo abdômen agudo), dor torácica, sonolência, torpor ou até mesmo coma e morte. O tratamento dessa complicação aguda consiste na reidratação com solução salina isotônica, insulinoterapia e correção do desequilíbrio eletrolítico com reposição do potássio.
Em contraposição à cetoacidose, outra complicação aguda do DMID pode ser a hipoglicemia, causada pelo excesso de insulina, omissão de refeição ou excesso de exercício. A hipoglicemia é diagnosticada de acordo os sintomas de hipoglicemia, podendo ser de ordem neuroglicopênica (calor, astenia, dificuldade de pensamento, desmaios, tontura, dificuldade de fala, visão borrada, coma) ou neurogênicas (palidez, sudorese, fome, tremor, taquicardia, ansiedade). O tratamento exige administração de glucose a 50% EV imediata, pois a hipoglicemia pode levar à morte. Em caso de dúvida se um paciente está tendo cetoacidose diabética ou hipoglicemia, deve-se administrar glucose, pois se for cetoacidose, não fará mal e ser for hipoglicemia, salvará a vida do paciente
Cetoacidose diabética
Hipoglicemia
Início
Lento
Súbito
Causa
Não-uso de insulina, estresse, doença, infecção
Excesso de insulina, omissão de refeição, exercício extenuante
Sinais/sintomas
Polidipsia, respiração de Kussmaul, náuseas, dor abdominal, hálito cetônico, desidratação
Fome, sudorese fria, astenia, cefaléia, tremores, convulsão, morte
Glicosúria
++++
0
Cetonúria
++++
0
Glicemia
Maior que 300 mg%
Menor que 60 mg%
A complicação aguda própria do DMNID é o coma hiperosmolar não-cetótico, análogo à cetoacidose diabética no DMID. É caracterizada por uma síndrome com extrema hiperglicemia e desidratação. A fisiopatilogia envolve um desequilíbrio entre a produção de glicose e sua excreção na urina. Ocorre principalmente em idosos com doenças intercorrentes que aumentam os níveis de hormônios antagônicos e de glicose plasmática, seguido por incapacidade de ingerir líquidos, levando à hiperosmolaridade e hiperglicemia.
Na admissão, os sintomas do paciente podem se confundir com os dos evento precipitante, como infarto do miocárdio, pneumonia, queimaduras ou pancreatite aguda. No exame, o paciente apresenta-se desidratado, com hipotensão, hipotermia, confusão, convulsões e coma. A ausência de respiração de Kussmaul é útil para diferenciar a complicação da cetoacidose.
6. Complicações Crônicas
As complicações do DM compreendem principalmente aquelas de ordem microvascular, como perda de visão, insuficiência renal, necrose de extremidades, neuropatia autonômica central, gastroparesia, neuropatia dolorosa etc, e macrovascular ou cardiovascular, como infarto de miocárdio, acidente vascular e doença vascular periférica. A doença cardiovascular é mais comum que as complicações microvasculares, sendo a principal causa de morte e incapacitação em pacientes com DMNID. O DM aumenta em 46,7 vezes o risco de insuficiência renal até os 44 anos, em 28,2 vezes o risco de amputação e em 24,7 vezes o risco de cegueira.
Os mecanismos que explicam o aparecimento das complicações crônicas são a glicação não-enzimática das proteínas (a qual leva, em última análise, a destruição tecidual e complicações macrovasculares), o aumento da atividade das vias que aumentam a redução de glucose a sorbitol pela aldose redutase, inibindo bombas de Na/K/ATPase e levando à deficiência de mio-inositol, e as anormalidades hemodinânicas.
- Neuropatia Diabética
A neuropatia diabética é a complicação mais freqüente e precoce do DM, podendo atingir 80 a 100% dos pacientes a longo prazo, sendo retardada e amenizada pelo controle glicêmico rigoroso.
As formas de neuropatia são mononeuropatia (afetando um nervo, com sintomas de paralisia de membro ou extremidade), polineuropatia periférica (caracterizado por déficit sensitivo simétrico em extremidades distais, associadas com dor) e neuropatia autonômica (manifestando-se com hiperhidrose, hipotensão postural, disfunção erétil ou distúrbios de motilidade da bexiga, esôfago, estômago, intestino e vesícula biliar)
- Lesões de extremidades
O "pé diabético" é a principal lesão de extremidades e é assim denominado devido às lesões dos pés decorrentes da neuropatia, deformidades e, principalmente, doença vascular periférica. Ocorre quase sempre após um trauma, mesmo pequeno, pode complicar com infecção e pode evoluir a um ponto de necrose, sendo necessário amputação total ou parcial da extremidade. Apresenta úlceras geralmente plantares, temperatura dos pés normal ou elevada, pele seca com rachaduras, pulsos palpáveis, dor ausente, ausência de sensação dolorosa plantar, pé rosáceo, entre outros. Pacientes diabéticos têm em torno de 15 vezes maior risco de sofrer amputaçöes que os não diabéticos e 20% dos amputados morrem em 2 anos. A insulinoterapia tem influência maléfica sobre os portadores de pés diabéticos; segundo estudos, o seu uso deve ser bem limitado. Focos infecciosos profundos podem manter o estado de desequilíbrio metabólico nos diabéticos portadores deles. Para se evitar possível amputação ou mesmo morte do paciente, há necessidade de tratamento clínico e cirúrgico especializado.
- Retinopatia Diabética
O DM é segunda causa de cegueira no mundo. A retinopatia é causada pela vasodilatação capilar, aumento da sua permeabilidade, espessamento da membrana basal, perda de células endoteliais, oclusão focal de capilar e formação de shunts arteriovenosos, culminando com isquemia da retina. É classificada em não-proliferativa - com áreas de oclusão e de dilatação capilar, microaneurismas, hemorragias, exsudatos algodonosos referentes a microinfartos e exsudatos duros formados pelo extravasamento de proteínas e de lipídeos - e proliferativa - com formação de neovasos que podem levar a hemorragia vítrea, descolamento de retina e cegueira. A retinopatia é manejada por meio de fotocoagulação com laser. Outras complicações oftalmológicas podem ocorrer, como maculopatia, catarata e glaucoma.
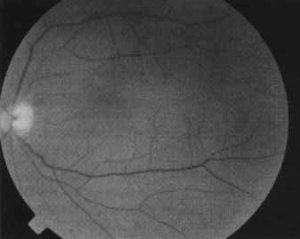
Figura 1. Fundo de Olho Normal
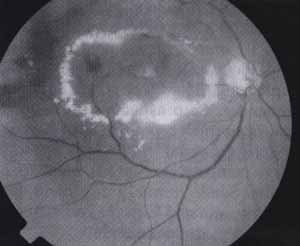
Figura 2. Retinopatia Diabética Não-proliferativa: exsudatos duros com padrão circinado primacular associado a hemorragia e edema de mácula
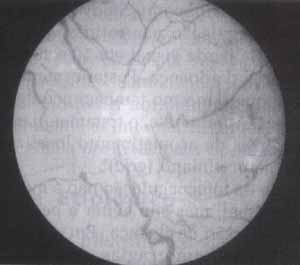
Figura 3. Retinopatia Diabética proliferativa: Observar neovascularização no pólo posterior
- Nefropatia
A nefropatia está presente em 15 % a 20 % dos pacientes com DMNID e em 30 % a 40 % dos com DMID com longa evolução. Trata-se da principal causa de insuficiência renal em pacientes que fazem diálise. É classificada em nefropatia incipiente, clínica e insuficiência renal crônica. Inicia com espessamento da membrana basal glomerular, aumento da matriz mesangial e espessamento hialino das arteríolas aferentes e eferentes. A microalbuminúria inicial evolui a macroalbuminúria, decréscimo do ritmo de filtração glomerular, síndrome nefrótica e insuficiência renal.
- Doenças macrovasculares
As alterações metabólicas e estruturais vasculares causadas pelo DM propiciam o acúmulo de lipídeos em artérias, levando a aterosclerose, hipertensão arterial, isquemia e infarto. As alterações comuns ao distúrbio endocrinológico e as alterações cardiovasculares são agrupadas numa entidade denominada Síndrome Plurimetabólica ou Síndrome X, que consiste em obesidade, hiperinsulinismo, hipertensão arterial, doença coronariana e alterações metabólicas como hiperuricemia, dislipidemia e hiperglicemia.
7. Tratamento
No DMID, o tratamento medicamentoso consiste principalmente no uso de insulina. Foi isolada pela primeira vez em 1921 pelo canadense Dr. Frederick Banting e pelo estudante de medicina Charles Best a partir de experiências em cães, rendendo-lhes o prêmio Nobel. Foi administrada a um paciente gravemente diabético, mudando seu curso de rápida deterioração e morte para um curso quase normal.
A insulina usada atualmente é de origem suína, diferindo de humana em apenas um aminoácido. Existem vários tipos, com uso indicado de acordo com o perfil glicêmico do paciente e com os parâmetros farmacocinéticos necessários. A insulina regular ou cristalina possui ação rápida, freqüentemente utilizada antes das refeições para diminuir o pico de glicemia pós-prandial. A insulina NPH (aspecto leitoso) tem ação mais prolongada, sendo maior ainda que a insulina chamada Lenta. A insulina Lispro (ultra-rápida), obtida através da modificação da insulina regular, apresenta ação ainda mais rápida, com início em 5 a 15 minutos após a administração.
A dose diária geralmente é de 0,52 a 0,75 U/kg, havendo vários esquemas de associação dos diversos tipos de insulina afim de se obter o melhor resultado. Cada ml de solução tem 100 U de insulina, devendo ser estocada na parte inferior da geladeira. A aplicação é subcutânea perpendicularmente. As complicações decorrentes da insulinoterapia compreendem hipoglicemia, lipodistrofia, alergia local ou sistêmica e infecção nos locais de aplicação.
O exercício desempenha papel importante, pois beneficia o sistema cardiovascular, abaixa a glicemia e diminui a resistência à insulina. Entretanto, deve-se dar atenção à possibilidade de hipoglicemia, além de haver monitorização freqüente às alterações metabólicas atribuídas ao exercício. São desaconselhadas práticas de alto risco, como alpinismo, mergulho, etc.
Para o DMNID, além de dieta e exercícios, podem ser usados os antidiabéticos orais, classificados como:
- Sulfuniluréias
: aumentam a secreção de insulina e diminuem a resistência à insulina em menor intensidade. São indicadas para pacientes magros que possuem deficiência de insulina em maior grau. Exemplo: glibeclamida, clorpropamida.- Biguanidas
: aumentam a sensibilidade à insulina e também reduzem a absorção intestinal de glicose, diminuem a gliconeogênese e aumentam a captação periférica de glicose. São indicadas para os pacientes obesos, que têm resistência aumentada para a insulina. Exemplo: metformina.- Inibidores da alfa-glicosidase
: inibem as enzimas que quebram o amido, retardam a absorção de carboidratos e atenuam a hiperglicemia pós-prandial. Exemplo acarbose.- Insulina
: suprime a produção hepática de glicose, melhora e sensibilidade do receptor.
8. Exames laboratoriais
Além da glicemia de jejum, o acompanhamento do paciente com diabetes deve ser feito com a dosagem de hemoglobina glicada (HbA1c) ou de frutosamina (os quais dão um parâmetro dos níveis de glicemia nos últimos 2 a 3 meses), perfil lipídico, ácido úrico, parcial de urina, microalbuminúria, uréia, creatinina, ritmo de filtração glomerular e ECG, todos com a freqüência determinada pela clínica e pelas características de cada paciente.
9. Diabetes e Nutrição
Em um estudo feito pela endocrinologista Marília de Brito Gomes, do Hospital Pedro Ernesto no Rio de janeiro, foi constatado que 2% dos adolescentes obesos eram diabéticos e 12 % tinham intolerância à glicose, e que houve um aumento significativo de outras doenças, como hipertensão arterial, taxa elevada de ácido úrico e triglicerídeos, bem como um baixo nível de HDL nestes pacientes. Um forte sinal de alerta é a medida da cintura de mais de 102cm para os homens e de mais de 88cm para as mulheres.
Associado à insulinoterapia, o paciente deve ser orientado quanto à dieta adequada com redução de gorduras saturadas, espaçamento das refeições e restrição moderada de calorias (déficit de 250-500 kcal por dia). A dieta deve se manter o mais próximo possível de uma dieta normal, não sendo necessário abolir complemente a ingesta de carboidratos simples.
Todos os planos de controle do paciente com diabetes tipo II devem incluir uma terapia nutricional individualizada e um programa de exercícios. Não existe mais uma dieta isolada considerada ideal, mas tanto a American Dietetic Association como a American Diabetes Association adotaram o conceito de que a dieta deve ser individualizada para pacientes com diabetes tipo II.
A ingestão de nutrientes deve ser planejada para prevenir grandes flutuações nos níveis de glicose sangüínea. Não é realista na maioria dos casos esperar que a redução de peso seja atingida somente através da terapia médica nutricional, sem uma terapia concomitante para modificação de comportamento e exercícios físicos.
REFERÊNCIAS BIBLIOGRÁFICAS
- AMERICAN DIABETES ASSOCIATION. Clinical Practice Recommendations. v. 20 supl. 1, 1997.
- Epidemiology and Public Health Aspects of Diabetes. World Health Statistics Quaterly. 45(4), 1992.
- FOSTER, D W. Diabetes melito. In: ISSELBACHER, K.J. et al.; Harrison Medicina Interna; 13 ed.; Rio de Janeiro: McGraw-Hill, 1995; p. 2079-2101.
- SOCIEDADE BRASILEIRA DE DIABETES. Consenso Brasileiro de Conceitos e Condutas para o Diabetes Mellitus;1997.
- STRYER, L.; Bioquímica; 3ª ed.; Rio de Janeiro: Guanabara Koogan, 1992.
- UNGER, R H, FOSTER, D W. Diabetes mellitus. In: WILSON, J. D. et al; Williams textbook of Endocrinology. 9th ed. Philadelphia: Saunders, 1998. p.973-1059.
- Seção Ciência, Jornal do Brasil. Domingo, 12 de setembro de 1999.
- PINHEIRO, A.; Diabetes Avança; Jornal do Brasil. Domingo, 27 de junho de 1999.
- LIPKIN, E.; New Strategies for the Treatment of Type II Diabetes. Journal of the American Dietetic Association. 1999; 99:329-334.
- EVANGELISTA, S. S. M; FRANKINI, A. D; VERGARA, E. M; SANTOS, M. E. R. C; BRAGA, V; Duque, A. C; DE LUCCIA, N; Kauffaman, P; GALLO, R. J.; VI Fórum da SBACV: O desafio do pé diabético / Challenge of the diabetic foot; Cir. vasc. angiol;13(1):7-10, mar. 1997.
- MAYALL, Rubens Carlos; GOMES FILHO, José Clei; D'AMICO, Mário José; Efeitos maléficos da insulinoterapia nos pés diabéticos / Malefic effects of insulinotherapy in diabetic foot; J. bras. med;67(4):168-80, out. 1994. ilus
POR
Gilberto Paz, Alencar Bittencourt, Denise J. Campos, Maíra B. Perotto , Vera Regina Koppe